Titrasi adalah salah satu metode analisis kimia yang paling umum digunakan untuk menentukan konsentrasi larutan. Titrasi dilakukan dengan menambahkan larutan baku (titran) secara bertahap ke dalam larutan yang akan ditentukan konsentrasinya (titrat) hingga terjadi perubahan warna indikator. Titik akhir titrasi adalah titik saat indikator berubah warna, yang menunjukkan bahwa reaksi antara titran dan titrat telah selesai.
Titran adalah larutan baku yang diketahui secara pasti konsentrasinya. Titran biasanya dimasukkan ke dalam buret, alat laboratorium yang digunakan untuk mengukur volume larutan secara akurat. Titrat adalah larutan yang akan ditentukan konsentrasinya. Titrat biasanya dimasukkan ke dalam labu Erlenmeyer.
Jenis-Jenis Titran
Ada dua jenis titran utama, yaitu:
- Titran asam: Titran asam adalah larutan asam yang telah diketahui konsentrasinya. Contoh titran asam adalah asam klorida (HCl) dan asam sulfat (H2SO4).
- Titran basa: Titran basa adalah larutan basa yang telah diketahui konsentrasinya. Contoh titran basa adalah natrium hidroksida (NaOH) dan kalium hidroksida (KOH).
Cara Melakukan Titrasi
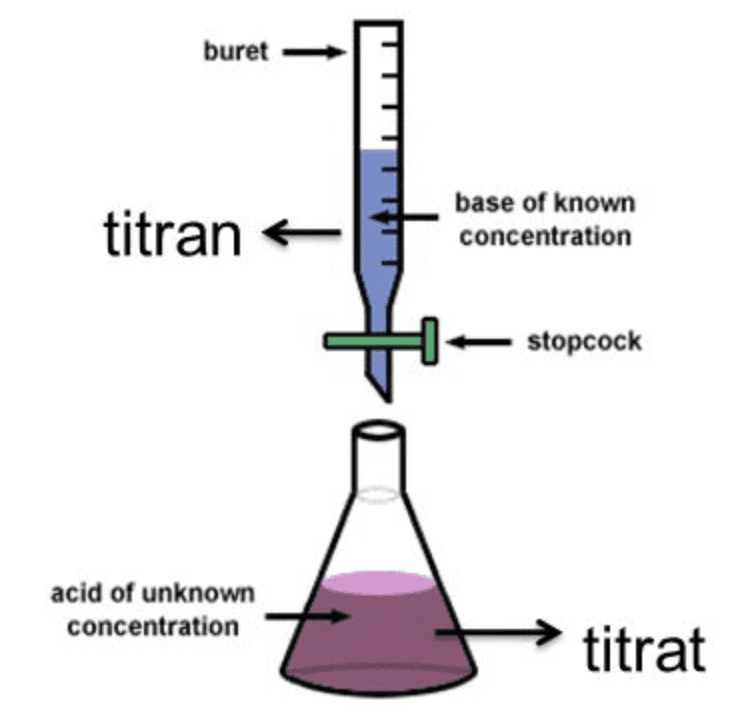
Untuk melakukan titrasi, diperlukan alat-alat dan bahan-bahan berikut:
- Buret
- Labu Erlenmeyer
- Penjepit buret
- Statif buret
- Indikator
- Pipet tetes
- Larutan baku (titran)
- Larutan yang akan ditentukan konsentrasinya (titrat)
Langkah-langkah melakukan titrasi:
- Masukkan larutan baku (titran) ke dalam buret.
- Pipet larutan yang akan ditentukan konsentrasinya (titrat) ke dalam labu Erlenmeyer.
- Tambahkan indikator ke dalam larutan titrat.
- Jepit buret ke statif buret.
- Buka kran buret dan tambahkan titran sedikit demi sedikit ke dalam labu Erlenmeyer sambil diaduk.
- Hentikan penambahan titran saat indikator berubah warna.
- Catat volume titran yang telah ditambahkan.
Contoh Titrasi
Berikut adalah contoh titrasi asam-basa:
Titrat: Asam klorida (HCl) 0,1 M Titran: Natrium hidroksida (NaOH) 0,1 M Indikator: Phenolphtalein
Langkah-langkah:
- Masukkan larutan NaOH 0,1 M ke dalam buret.
- Pipet 25 mL larutan HCl 0,1 M ke dalam labu Erlenmeyer.
- Tambahkan 2-3 tetes indikator phenolphthalein ke dalam larutan HCl 0,1 M.
- Jepit buret ke statif buret.
- Buka kran buret dan tambahkan larutan NaOH 0,1 M sedikit demi sedikit ke dalam labu Erlenmeyer sambil diaduk.
- Hentikan penambahan larutan NaOH 0,1 M saat indikator berubah warna dari bening menjadi merah muda.
- Catat volume larutan NaOH 0,1 M yang telah ditambahkan.
Misalkan volume larutan NaOH 0,1 M yang telah ditambahkan adalah 25 mL. Maka, konsentrasi larutan HCl 0,1 M dapat dihitung menggunakan rumus berikut:
M1V1 = M2V2Dimana:
- M1 adalah konsentrasi larutan titran (NaOH 0,1 M)
- V1 adalah volume larutan titran yang telah ditambahkan (25 mL)
- M2 adalah konsentrasi larutan titrat (HCl 0,1 M)
- V2 adalah volume larutan titrat (25 mL)
0,1 M x 25 mL = M2 x 25 mL
M2 = 0,1 MJadi, konsentrasi larutan HCl 0,1 M adalah 0,1 M.
Kesimpulan
Titran adalah larutan baku yang digunakan untuk menentukan konsentrasi larutan lain. Titran harus diketahui konsentrasinya dengan pasti agar hasil titrasi dapat dipercaya. Titran dapat diklasifikasikan berdasarkan jenis reaksi yang terjadi, dan pemilihan titran yang tepat harus mempertimbangkan beberapa faktor.







