Oksidasi dan reduksi adalah dua istilah yang sangat umum ditemukan dalam ilmu kimia. Keduanya berhubungan dengan peran dalam reaksi kimia yang melibatkan atom, unsur, dan senyawa yang terkandung dalam bahan kimia. Dalam suatu reaksi oksidasi dan reduksi tidak dapat dipisahkan oleh serah terima elektron, penerimaan dan pelepasan oksigen serta hidrogen, dan perubahan bilangan oksidasi.
Oksidasi dan Reduksi
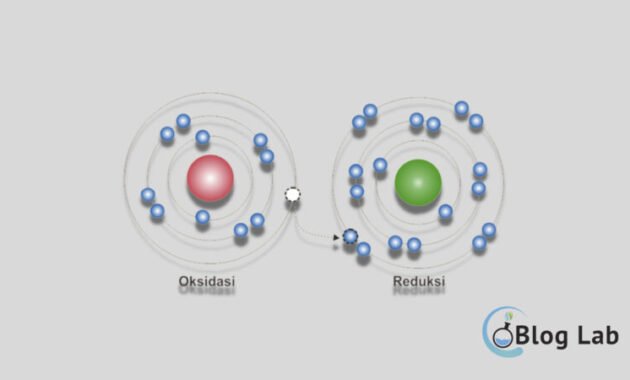
Oksidasi secara singkat adalah proses dimana suatu zat mengoksidasi zat lain. Sedangkan reduksi adalah proses dimana suatu zat mereduksi zat lain. Dalam suatu reaksi kimia, kedua proses ini saling terkait dengan oksidasi yang mengikat oksigen dan reduksi yang mengeluarkannya.
Namun, yang pasti baik oksidasi maupun reduksi dalam suatu reaksi kimia dapat terjadi secara bersamaan. Proses ini yang disebut dengan reaksi redoks.
Pengertian Oksidasi dan Reduksi
Berikut adalah beberapa definisi dari keduanya diantaranya yaitu:
- Menurut teori klasik, oksidasi adalah proses di mana suatu zat menangkap oksigen dan kehilangan hidrogen. Sedangkan reduksi adalah proses di mana suatu zat kehilangan oksigen dan menangkap hidrogen. Namun, konsep oksidasi dan reduksi telah berkembang seiring dilakukannya penelitian dan percobaan. Kedua proses ini sering disingkat menjadi reaksi redoks (reduksi-oksidasi).
- Menurut teori modern, oksidasi adalah proses di mana suatu zat kehilangan satu atau lebih elektron. Oleh karena itu, zat yang mengalami oksidasi akan menjadi lebih positif. Sedangkan reduksi adalah proses di mana suatu zat menerima satu atau lebih elektron, sehingga zat yang mengalami reduksi muatannya akan lebih negatif.
Definisi dari kedua teori ini sejalan dengan konsep yang menjelaskan tentang pengertian oksidasi dan reduksi, yaitu meliputi serah terima elektron, perubahan bilangan oksidasi, serta penerimaan atau pelepasan oksigen dan hidrogen.
Selain itu, pengertian oksidasi dan reduksi juga dapat dilihat dari perubahan bilangan oksidasi atau yang dikenal sebagai biloks. Reduksi didefinisikan sebagai reaksi yang menyebabkan penurunan biloks, sementara oksidasi didefinisikan sebagai reaksi yang menyebabkan peningkatan biloks.
1. Reaksi Reduksi Oksidasi (Redoks)
Proses redoks dibagi menjadi dua bagian, yaitu setengah berkurang dan setengah teroksidasi. Kedua proses ini selalu terjadi secara bersamaan, dimana setengah berkurang menerima elektron dan menyebabkan bilangan oksidasi berkurang, sementara setengah teroksidasi kehilangan elektron dan menyebabkan bilangan oksidasi bertambah. Spesies yang melakukan pertukaran elektron pada reaksi redoks disebut dengan agen pengoksidasi dan agen pereduksi.
Pemahaman tentang tingkat kesetimbangan reaksi dapat ditentukan dengan analisis gaya elektromotif pada sel galvanik. Kondisi kesetimbangan terjadi ketika konsentrasi reaktan dan produk tidak cenderung berubah. Sel galvanik adalah sel yang muncul spontan pada reaksi kimia dan dapat menghasilkan energi listrik yang dapat dimanfaatkan, yang diukur dalam satuan voltase atau potensial sel.
2. Aturan Penetapan Oksidasi
Keadaan oksidasi pada suatu unsur terkait dengan jumlah elektronnya. Atom dapat kehilangan, memperoleh atau menukar elektron saat bergabung dengan atom lain dalam suatu senyawa. Ada tujuh aturan yang digunakan untuk menentukan oksidasi, yaitu:
- Keadaan oksidasi atom individu bernilai nol (0).
- Keadaan oksidasi total semua atom dalam spesies netral bernilai 0 dan pada ion sama dengan muatan ionnya.
- Logam golongan 1 memiliki tingkat oksidasi +1, logam golongan 2 memiliki tingkat oksidasi +2.
- Keadaan oksidasi fluor bernilai -1 dalam suatu senyawa.
- Hidrogen biasanya memiliki nilai oksidasi +1 dalam senyawa.
- Oksigen biasanya memiliki nilai oksidasi -2 dalam senyawa.
- Pada senyawa logam biner, elemen dari grup 17 memiliki keadaan oksidasi -1, elemen dari grup 16 memiliki keadaan oksidasi -2, dan elemen dari grup 15 memiliki keadaan oksidasi -3.
Contoh Oksidasi dan Reduksi
Berikut ini contoh dan jenis-jenis reaksi reduksi oksidasi, di antaranya:
1. Reaksi Kombinasi
Reaksi kombinasi adalah jenis reaksi redoks yang paling sederhana, yang melibatkan penggabungan elemen menjadi suatu senyawa kimia. Dalam reaksi redoks, baik reduksi maupun oksidasi terjadi pada saat yang sama. Persamaan umum yang digunakan untuk menggambarkan reaksi kombinasi:
A + B -> AB2. Reaksi Penguraian
Reaksi penguraian juga dikenal sebagai reaksi dekomposisi. Reaksi ini berlawanan dengan reaksi kombinasi, dimana senyawa kimia dipecah menjadi unsur-unsur yang berdiri sendiri. Berikut persamaannya:
AB -> A + B3. Reaksi Penggantian Tunggal
Reaksi penggantian tunggal dalam kimia melibatkan “penggantian” elemen reaktan dengan elemen lain dalam produk. Contohnya dapat dilihat pada persamaan berikut ini:
A + BC -> AB + C
4. Reaksi Penggantian GandReaksi Pembakarana
Reaksi penggantian ganda mirip dengan penggantian tunggal. Namun pada reaksi penggantian ganda, dua elemen reaktan digantikan dengan dua elemen pada produk:
AB + CD -> AD + CB
5. Reaksi Pembakaran
Reaksi pembakaran selalu melibatkan oksigen dalam bentuk O2. Reaksi ini terjadi secara eksoterm, yang berarti reaksi pembakaran menghasilkan produk berupa panas. Contoh reaksi pembakaran yang sering ditemukan dalam kehidupan sehari-hari adalah pada cahaya dan panas.
CxHy + O2 -> CO2 +H2O
Reaksi pembakaran selalu melibatkan reaksi redoks dengan bahan kimia yang teroksidasi oleh oksigen. Ada banyak jenis bahan kimia yang dapat terbakar di lingkungan, contohnya titanium dan magnesium yang dapat terbakar pada nitrogen. Persamaan reaksi yang terjadi sebagai berikut:
2Ti + N2 (g) -> 2TiN
3Mg (s) + N2 (g) -? Mg3N2
Ada juga bahan kimia yang dapat dioksidasi selain menggunakan oksigen, contohnya Cl2 atau F2. Reaksi yang menggunakan keduanya disebut juga sebagai reaksi pembakaran.
6. Reaksi Disproporsi
Reaksi disproporsi ditandai dengan suatu zat tunggal yang dapat teroksidasi dan terreduksi pada saat yang sama. Persamaan umum yang digunakan untuk menggambarkan reaksi disproporsi adalah sebagai berikut:
2A -> A + n + A – n
Pada persamaan reaksi di atas, n adalah jumlah elektron yang ditransfer. Reaksi disproporsi dapat terjadi tanpa molekul netral yang menjadi reaktan awal. Reaksi ini juga melibatkan lebih dari dua spesies kimia namun dengan tingkat oksidasi yang berbeda.
Pemanfataan Oksidasi dan Reduksi
Reaksi redoks yang mengkombinasikan reduksi dan oksidasi sering dimanfaatkan dalam proses industri. Industri yang biasa menerapkan reaksi ini antara lain industri pengolahan logam, industri pelapisan ikatan logam, serta industri aki dan baterai.
Berikut penjelasan pada masing-masing industri:
1. Pengolahan Logam
Biji logam dapat ditemukan dalam berbagai bentuk seperti oksida, karbonat, dan sulfida. Biji dari karbonat dan sulfida harus diolah terlebih dahulu menjadi oksida melalui proses pemanggangan. Setelah itu, biji oksida akan direduksi menjadi logam melalui proses yang sesuai.
2. Pelapisan Logam
Proses pelapisan logam dilakukan dengan cara mengoksidasi logam yang akan dilapisi, kemudian mengreduksi unsur lapisan yang dikehendaki dan melekatkan pada logam yang diinginkan. Tujuannya adalah untuk meningkatkan kualitas logam, seperti mencegah perkaratan pada besi dengan dilapisi seng atau krom, atau pada tembaga dengan dilapisi emas.
3. Aki dan Baterai
Aki dan baterai yang digunakan dalam kehidupan sehari-hari memainkan peran penting sebagai sumber energi listrik searah. Prinsip kerja dari aki dan baterai berdasarkan reaksi redoks.
Kesimpulan
Dapat dikatakan bahwa oksidasi dalam reaksi kimia melibatkan interaksi antara oksigen dengan zat lain, yang mengakibatkan pengikatan oksigen, pelepasan elektron, dan peningkatan bilangan oksidasi. Sebaliknya, reduksi berkaitan dengan pelepasan oksigen, penangkapan elektron, dan penurunan bilangan oksidasi. Oksidasi dapat memberikan efek positif seperti pada pembentukan alumunium yang tahan lama, namun juga dapat merugikan seperti pada perkaratan besi atau perubahan warna buah yang dipotong.
Itulah tadi artikel yang dapat kami sajikan untuk para pembaca mengenai pengertian oksidasi dan reduksi, reaksi, aturan, dan contoh aplikasinya dalam kehidupan sehari-hari. Semoga memberikan pemahaman yang baik bagi semua pihak yang membutuhkannya.







