Fakta Menarik yang Harus Kamu Tahu tentang Sifat-Sifat Gas Ideal!
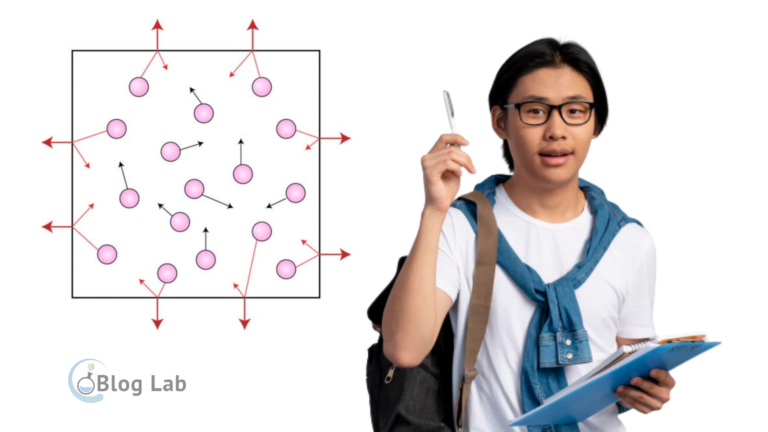
Hukum-hukum Gas Ideal
Gas ideal juga memiliki beberapa hukum yang mengatur hubungan antara variabel-variabel keadaannya, yaitu tekanan (P), volume (V), temperatur (T), dan jumlah zat (n). Hukum-hukum tersebut antara lain:
Hukum Boyle
Hukum Boyle menyatakan bahwa tekanan gas berbanding terbalik dengan volume gas, jika temperatur dan jumlah zat gas dijaga tetap konstan. Secara matematis, hal ini dapat dituliskan sebagai:
Atau dalam bentuk lain:
Di mana k adalah konstanta proporsionalitas. Sehingga, untuk persamaan perbandingan keadaan awal dan akhir gas sesuai hukum Boyle, bisa dituliskan sebagai:
Hukum Charles
Hukum Charles menyatakan bahwa temperatur mutlak dan volume gas berbanding lurus, jika tekanan dan jumlah zat gas dijaga tetap konstan. Secara matematis, hal ini dapat dituliskan sebagai:
Atau dalam bentuk lain:
Di mana k adalah konstanta proporsionalitas. Sehingga, untuk persamaan perbandingan keadaan awal dan akhir gas sesuai hukum Charles, bisa dituliskan sebagai:
Hukum Gay-Lussac
Hukum Gay-Lussac menyatakan bahwa tekanan dan temperatur mutlak gas berbanding lurus, jika volume dan jumlah zat gas dijaga tetap konstan. Secara matematis, hal ini dapat dituliskan sebagai:
Atau dalam bentuk lain:
Di mana k adalah konstanta proporsionalitas. Sehingga, untuk persamaan perbandingan keadaan awal dan akhir gas sesuai hukum Gay-Lussac, bisa dituliskan sebagai: