Apa Itu Proses Reduksi dan Bagaimana Cara Kerjanya?
Dalam ilmu kimia, reaksi reduksi merupakan salah satu konsep dasar yang sangat penting untuk dipahami. Proses ini sering dikaitkan dengan reaksi oksidasi dalam sebuah reaksi yang dikenal sebagai reaksi redoks (reduksi-oksidasi). Memahami reduksi akan membantu kita memahami berbagai fenomena kimia, seperti proses korosi, elektrokimia, hingga reaksi dalam metabolisme tubuh.
Artikel ini akan membahas secara mendalam mengenai pengertian reduksi, bagaimana cara kerjanya, contoh reaksi reduksi, serta aplikasinya dalam kehidupan sehari-hari.
Pengertian Proses Reduksi
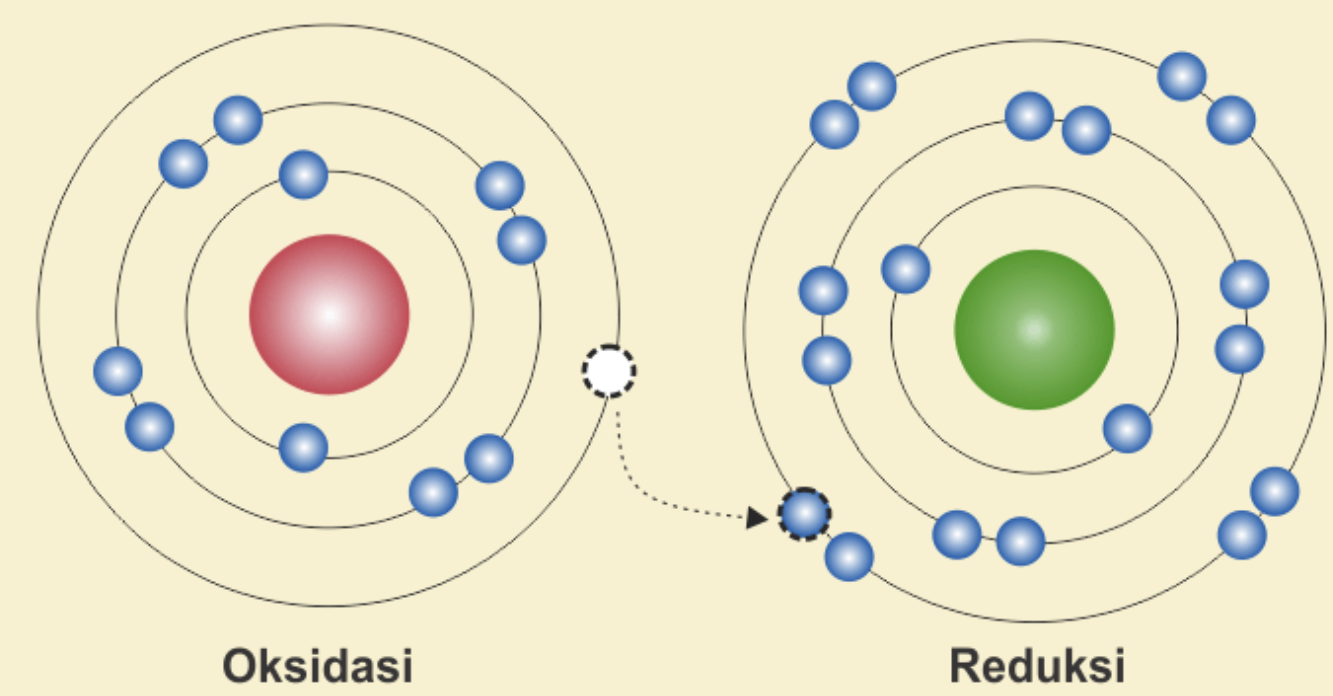
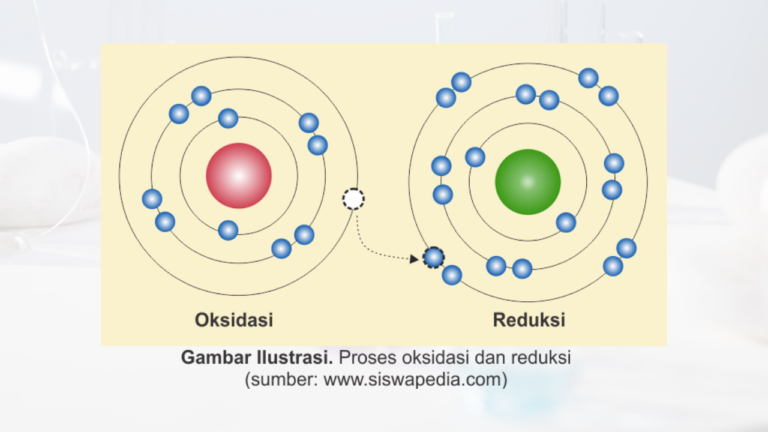
Secara sederhana, reduksi adalah proses penurunan bilangan oksidasi suatu zat akibat penerimaan elektron. Dalam kata lain, suatu zat dikatakan mengalami reduksi jika ia memperoleh elektron selama reaksi kimia berlangsung.
Reduksi biasanya terjadi bersamaan dengan oksidasi, di mana suatu zat mengalami kehilangan elektron. Kedua proses ini berjalan secara simultan dalam sebuah reaksi redoks.
Definisi Reduksi dalam Beberapa Konteks
- Menurut Bilangan Oksidasi
- Reduksi adalah proses di mana bilangan oksidasi suatu unsur berkurang.
- Menurut Transfer Elektron
- Reduksi adalah proses penerimaan elektron oleh suatu zat.
- Menurut Pengikatan Oksigen atau Hidrogen
- Reduksi dapat diartikan sebagai proses pelepasan oksigen atau pengikatan hidrogen dalam suatu senyawa.
Cara Kerja Proses Reduksi
Proses reduksi terjadi melalui beberapa mekanisme tergantung pada sistem reaksinya. Namun, prinsip dasarnya selalu melibatkan penerimaan elektron dan penurunan bilangan oksidasi.
1. Reaksi Redoks (Reduksi-Oksidasi)
Reduksi selalu berpasangan dengan oksidasi dalam reaksi redoks. Sebagai contoh, pada reaksi berikut:
Ion tembaga (Cu²⁺) mengalami reduksi karena menerima dua elektron dan berubah menjadi tembaga logam (Cu).
Sebaliknya, dalam reaksi berikut:
Seng (Zn) mengalami oksidasi karena melepaskan elektron.
2. Proses Elektrokimia
Dalam sel elektrokimia, reduksi terjadi di katoda, tempat ion-ion dalam larutan menerima elektron dan mengalami reduksi. Sebagai contoh, dalam sel elektrolisis:
Ion hidrogen (H⁺) mengalami reduksi menjadi gas hidrogen (H₂).
3. Reduksi dalam Metalurgi
Reduksi juga digunakan dalam ekstraksi logam dari bijihnya. Contohnya, dalam pembuatan besi dari bijih besi (Fe₂O₃):
Dalam reaksi ini, karbon monoksida (CO) bertindak sebagai agen pereduksi yang menghilangkan oksigen dari bijih besi, sehingga logam besi (Fe) diperoleh.
Contoh Reaksi Reduksi
Berikut beberapa contoh reaksi reduksi dalam berbagai bidang:
- Reaksi dalam Sel Baterai
- Pada baterai zinc-carbon:Mangan dioksida (MnO₂) mengalami reduksi menjadi Mn(OH)₂.
- Reaksi Fotosintesis
- Proses fotosintesis melibatkan reduksi karbon dioksida menjadi glukosa:Karbon dioksida mengalami reduksi menjadi glukosa (C₆H₁₂O₆).
- Reaksi dalam Tubuh Manusia
- Dalam respirasi seluler, oksigen mengalami reduksi menjadi air:Oksigen menerima elektron dan menjadi air.
Aplikasi Reduksi dalam Kehidupan Sehari-hari
- Proses Pemurnian Logam
- Reduksi digunakan dalam industri metalurgi untuk mendapatkan logam murni dari bijihnya.
- Sel Elektrokimia (Baterai dan Aki)
- Reaksi reduksi digunakan dalam baterai untuk menghasilkan listrik yang digunakan dalam berbagai perangkat elektronik.
- Fotosintesis pada Tumbuhan
- Reduksi karbon dioksida dalam fotosintesis membantu tumbuhan menghasilkan makanan bagi makhluk hidup lainnya.
- Reaksi dalam Tubuh Manusia
- Reduksi oksigen dalam respirasi seluler memungkinkan produksi energi dalam tubuh kita.
- Pengolahan Limbah dan Perlindungan Lingkungan
- Reduksi digunakan dalam pengolahan air limbah untuk menghilangkan zat beracun dengan cara mengubahnya menjadi zat yang lebih aman.
Kesimpulan
Proses reduksi merupakan salah satu konsep fundamental dalam kimia yang melibatkan penerimaan elektron dan penurunan bilangan oksidasi. Reduksi selalu terjadi bersama dengan oksidasi dalam reaksi redoks, dan memiliki berbagai aplikasi penting dalam kehidupan sehari-hari, mulai dari industri metalurgi, sel elektrokimia, fotosintesis, hingga reaksi biologis dalam tubuh manusia.
Dengan memahami konsep reduksi, pelajar dapat lebih mudah memahami berbagai reaksi kimia yang terjadi di sekitar kita serta aplikasinya dalam sains dan teknologi.
Semoga artikel ini membantu Anda dalam mempelajari konsep reduksi secara lebih mendalam!
Sumber referensi:
- Atkins, P. & de Paula, J. (2018). Physical Chemistry (11th ed.). Oxford University Press.
- Chang, R. & Goldsby, K. (2016). Chemistry (13th ed.). McGraw-Hill Education.
- Kotz, J. C., Treichel, P. M., & Townsend, J. R. (2018). Chemistry & Chemical Reactivity (10th ed.). Cengage Learning.