Struktur Atom: Menelusuri Sejarah dan Komponen Dasarnya

Atom adalah partikel terkecil penyusun materi yang tidak dapat dibagi lagi dalam reaksi kimia biasa. Konsep ini pertama kali diperkenalkan oleh John Dalton pada tahun 1807. Menurut Dalton, atom adalah partikel terkecil penyusun suatu materi yang tidak dapat diciptakan atau dimusnahkan. Semua atom dari satu unsur memiliki sifat yang sama dalam segala hal, seperti ukuran, bentuk, dan massa. Namun, perkembangan ilmu pengetahuan membawa kita pada pemahaman yang lebih mendalam tentang struktur atom, yang kini kita kenal sebagai teori atom modern.
Penemuan Elektron

Elektron ditemukan oleh J.J. Thomson pada tahun 1897 melalui eksperimen tabung sinar katoda. Thomson menemukan bahwa sinar tersebut terdiri dari partikel bermuatan negatif yang kemudian dikenal sebagai elektron. Penemuan ini mengubah pandangan kita tentang atom, yang sebelumnya dianggap sebagai partikel tunggal yang tak terpecah, menjadi suatu sistem yang lebih kompleks dengan partikel-partikel penyusunnya.
Proton dan Neutron
Pada tahun 1911, Ernest Rutherford, melalui eksperimen hamburan partikel alfa, mengusulkan bahwa atom memiliki inti kecil yang bermuatan positif yang disebut proton. Proton adalah partikel bermuatan positif yang terdapat di dalam inti atom. Selain itu, James Chadwick pada tahun 1932 menemukan neutron, partikel yang tidak bermuatan tetapi memiliki massa yang hampir sama dengan proton. Neutron berperan penting dalam menstabilkan inti atom.
Struktur Atom Modern
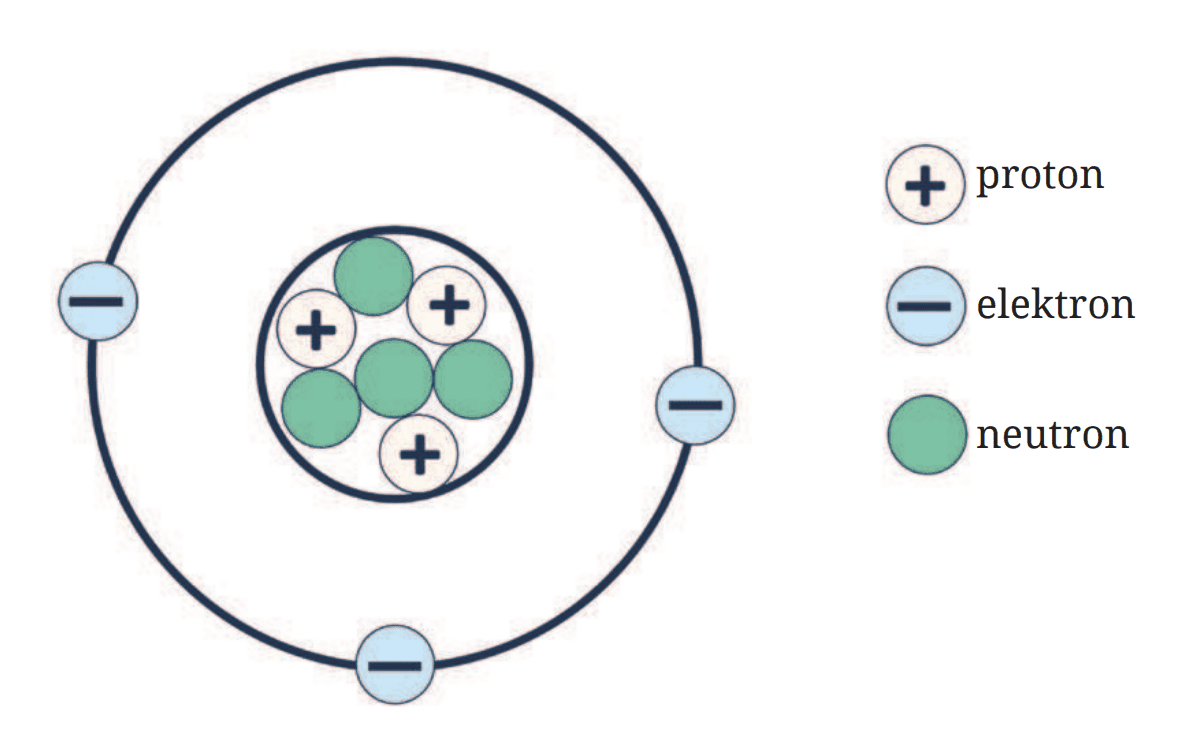
Menurut teori atom modern, atom terdiri dari tiga partikel dasar: proton, neutron, dan elektron. Proton dan neutron berada di dalam inti atom, sedangkan elektron bergerak mengelilingi inti dalam orbit-orbit tertentu. Proton memiliki muatan positif, neutron tidak bermuatan, dan elektron memiliki muatan negatif. Struktur ini dapat dilihat pada Gambar 1.2 di atas.
Inti atom yang mengandung proton dan neutron disebut nukleus, dan elektron mengelilingi nukleus dalam orbit yang disebut kulit elektron. Elektron-elektron ini bergerak sangat cepat, sehingga membentuk awan elektron di sekitar nukleus. Jumlah proton dalam inti atom menentukan identitas unsur tersebut dan disebut nomor atom. Sedangkan jumlah total proton dan neutron dalam inti disebut nomor massa.
Teori Atom Bohr
Niels Bohr, pada tahun 1913, mengusulkan model atom yang lebih rinci dengan memperkenalkan konsep tingkat energi diskret. Menurut Bohr, elektron mengelilingi inti dalam orbit-orbit tertentu yang memiliki tingkat energi tertentu. Elektron dapat berpindah dari satu orbit ke orbit lain dengan menyerap atau melepaskan energi dalam bentuk foton. Model ini membantu menjelaskan spektrum garis dari atom hidrogen dan menjadi dasar bagi perkembangan teori mekanika kuantum.
Mekanika Kuantum dan Model Atom Modern
Mekanika kuantum memberikan gambaran yang lebih akurat tentang struktur atom dibandingkan dengan model Bohr. Dalam model ini, elektron tidak dianggap bergerak dalam orbit tetap, melainkan dalam orbital, yaitu daerah di sekitar inti atom tempat kemungkinan menemukan elektron paling besar. Orbital ini memiliki bentuk dan ukuran yang berbeda tergantung pada energi dan momentum sudut elektron.
Schrödinger dan Heisenberg adalah dua ilmuwan yang berperan penting dalam pengembangan mekanika kuantum. Persamaan Schrödinger memungkinkan kita untuk menghitung kemungkinan menemukan elektron di dalam orbital tertentu, sedangkan prinsip ketidakpastian Heisenberg menyatakan bahwa kita tidak dapat mengetahui dengan pasti posisi dan momentum elektron secara simultan.
Isotop dan Aplikasi Struktur Atom
Isotop adalah varian dari unsur yang memiliki jumlah proton yang sama tetapi jumlah neutron yang berbeda. Sebagai contoh, karbon memiliki beberapa isotop, termasuk karbon-12 dan karbon-14. Isotop ini memiliki sifat kimia yang sama tetapi memiliki sifat fisik yang berbeda. Isotop radioaktif, seperti karbon-14, digunakan dalam berbagai aplikasi termasuk penentuan umur benda purbakala melalui teknik radiokarbon.
Pemahaman tentang struktur atom juga berperan penting dalam berbagai bidang teknologi dan industri. Misalnya, dalam bidang kedokteran, teknik pencitraan seperti MRI dan CT scan bergantung pada pengetahuan tentang interaksi antara partikel subatomik dan medan elektromagnetik. Di bidang energi, reaktor nuklir memanfaatkan reaksi fusi dan fisi nuklir yang melibatkan inti atom.
Kesimpulan
Penemuan dan pemahaman tentang struktur atom telah mengalami perkembangan yang pesat sejak pertama kali diperkenalkan oleh John Dalton. Penemuan elektron oleh J.J. Thomson, serta proton dan neutron oleh Ernest Rutherford dan James Chadwick, telah mengubah cara kita memandang atom sebagai partikel dasar penyusun materi. Model atom modern yang didukung oleh teori mekanika kuantum memberikan gambaran yang lebih kompleks dan akurat tentang struktur atom, yang tidak hanya terdiri dari proton, neutron, dan elektron, tetapi juga melibatkan konsep orbital dan tingkat energi.
Struktur atom tidak hanya menjadi dasar bagi ilmu kimia dan fisika, tetapi juga memiliki aplikasi luas dalam berbagai bidang teknologi dan industri. Pemahaman yang mendalam tentang atom memungkinkan kita untuk terus mengembangkan teknologi baru dan meningkatkan kualitas hidup manusia. Dengan terus melakukan penelitian dan eksperimen, kita dapat berharap untuk menemukan lebih banyak lagi tentang misteri dan keajaiban yang tersembunyi dalam dunia subatomik.
FAQ
1. Apa itu atom?
Atom adalah partikel terkecil penyusun materi yang tidak dapat dibagi lagi dalam reaksi kimia biasa. Atom terdiri dari proton, neutron, dan elektron.
2. Siapa yang pertama kali menemukan elektron dan bagaimana caranya?
Elektron ditemukan oleh J.J. Thomson pada tahun 1897 melalui eksperimen tabung sinar katoda. Thomson menemukan bahwa sinar tersebut terdiri dari partikel bermuatan negatif yang kemudian dikenal sebagai elektron.
3. Apa itu proton dan neutron?
Proton adalah partikel bermuatan positif yang terdapat di dalam inti atom. Neutron adalah partikel yang tidak bermuatan tetapi memiliki massa yang hampir sama dengan proton. Kedua partikel ini terdapat di dalam inti atom dan berperan penting dalam menstabilkan inti.
4. Bagaimana model atom Bohr berbeda dari model atom sebelumnya?
Niels Bohr mengusulkan bahwa elektron mengelilingi inti dalam orbit-orbit tertentu yang memiliki tingkat energi diskret. Elektron dapat berpindah dari satu orbit ke orbit lain dengan menyerap atau melepaskan energi. Model ini membantu menjelaskan spektrum garis dari atom hidrogen.
5. Apa itu mekanika kuantum dan bagaimana pengaruhnya terhadap model atom?
Mekanika kuantum memberikan gambaran yang lebih akurat tentang struktur atom dibandingkan dengan model Bohr. Elektron tidak dianggap bergerak dalam orbit tetap, melainkan dalam orbital yang merupakan daerah dengan kemungkinan terbesar untuk menemukan elektron. Mekanika kuantum memperkenalkan konsep bahwa kita tidak dapat mengetahui posisi dan momentum elektron secara simultan dengan pasti.
Sumber: Kemendikbudristek/Nanda Saridewi (2022)